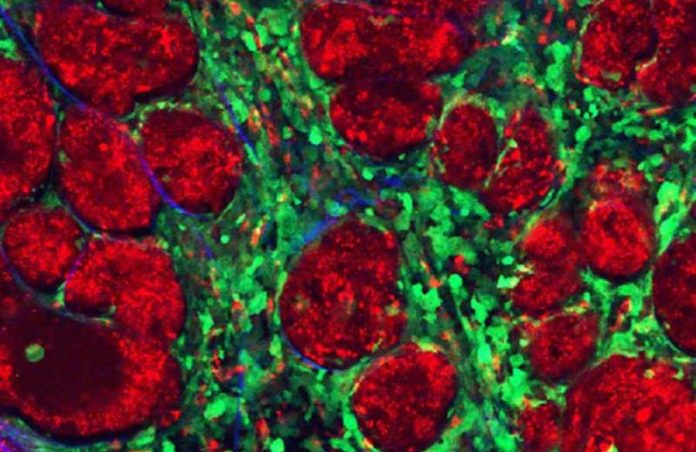
Nueva generación de microgeles con nanopartículas de oro para tratar tumores.
España. Un equipo internacional de científicos, en el que participa un físico de la Universidad de Granada (UGR), ha desarrollado unos microgeles fabricados con nanopartículas de oro con numerosas aplicaciones en el ámbito de la biomedicina, entre ellas diagnosticar y tratar tumores.
Los microgeles son partículas blandas micrométricas formadas por redes de polímeros entrecruzados. Estás partículas poseen la propiedad de que su tamaño y grado de porosidad puede variar con las propiedades del medio (temperatura, pH, radiación electromagnética, etc…). Los microgeles se utilizan en productos de higiene y agrícolas para retener el agua. Sin embargo, existen novedosas aplicaciones tecnológicas como la administración controlada de fármacos, interruptores optoelectrónicos o músculos artificiales.
En el caso de la nanomedicina, el potencial de los microgeles poliméricos es aún más prometedor cuando éstos forman sistemas híbridos constituidos por microgeles dopados con nanopartículas inorgánicas. Estos sistemas híbridos ya se han usado como nuevos agentes de contraste para la obtención de bioimágenes y en ensayos controlados antibacterianos.
Sin embargo, la síntesis de estos materiales híbridos sigue siendo una tarea ardua debido a la necesidad de controlar características como el tamaño de las partículas y los niveles de dopaje, para una aplicación determinada.
Sin embargo, la síntesis de estos materiales híbridos sigue siendo una tarea ardua debido a la necesidad de controlar características como el tamaño de las partículas y los niveles de dopaje, para una aplicación determinada.
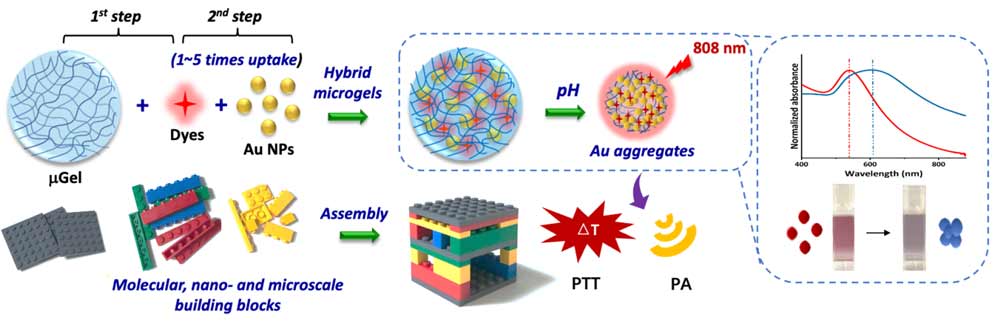
Cómo es el microgel con partículas de oro que ha diseñado la UGR
El mayor logro de la investigación en la que participa la UGR, publicada en la revista ACS Applied Materials & Interfaces, es el de presentar una novedosa estrategia para la formación de partículas híbridas basada en el ensamblaje de microgeles termosensibles con tintes y nanopartículas de oro, mediante sucesivos pasos de incubación.
Los sistemas resultantes presentan un gran poder de encapsulación, así como una alta capacidad de fotoluminiscencia y por tanto pueden ser usados en aplicaciones de nanomedicina como son la hipertermia fotoactivada (estrategia anticancerígena basada en la eliminación de células tumorales incrementando la temperatura por encima de los 42ºC con un láser de diodo), imagen fotoacústica (técnica oncológica que combina tecnología de luz y de ultrasonido para identificar células tumorales), la internalización celular, (técnica biomédica por la cual un agente farmacológico es capaz de ingresar en la célula para actuar sobre blancos moleculares intracelulares), imagen intracelular (técnica adecuada para visualizar nanopartículas en el interior de las células) y la terapia fototérmica (uso experimental de la radiación electromagnética para el tratamiento de diversas enfermedades como el cáncer).
En particular, este sistema híbrido es un firme candidato teranóstico (suma de las palabras terapia y diagnóstico) como agentes para la visualización y el tratamiento simultáneo de tumores.
Este trabajo ha sido el resultado de una larga colaboración entre investigadores de cinco centros de investigación; tres instituciones de París (Laboratoire de Chimie et de Biochimie Pharmacologiques et Toxicologiques, Matière et Systèmes Complexes y Laboratoire d’Imagerie Biomédicale) y dos centros españoles: la Universidad de Jaén y la UGR.
“Mientras los investigadores franceses han realizado todo el trabajo de síntesis y experimental, en España hemos realizado simulaciones computacionales para poder interpretar los resultados y esclarecer los mecanismos físicos que subyacen en la formación de estos sistemas híbridos”, destaca Alberto Martín Molina, catedrático del departamento de Física Aplicada de la UGR que participa en el estudio.